
Manual Cadifa de procedimentos administrativos: confira a nova versão
Anvisa publica versão atualizada com orientações sobre as etapas de submissão, via Solicita, de petições relacionadas à Cadifa.
A Anvisa informa que já está disponível a terceira versão do Manual Cadifa de procedimentos administrativos. O documento foi atualizado tendo em vista a migração do peticionamento dos assuntos relacionados à Cadifa (Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo) para o Sistema Solicita e em continuidade à implantação do novo marco regulatório de insumos farmacêuticos ativos (IFAs).
A mudança faz parte da transformação digital da Anvisa, que tem como objetivo padronizar os procedimentos e possibilitar o acompanhamento das petições protocoladas na Agência. Com a migração, não haverá mais peticionamento de assuntos relacionados à Cadifa por protocolo manual, nem pelo sistema de peticionamento.
Na nova versão do manual, portanto, foi excluído o peticionamento com protocolo manual e acrescidas informações sobre usuário regulatório, tabela comparativa, visualização de arquivos submetidos via Sistema Solicita e armazenamento de submissão não concluída. As empresas farão também pelo Solicita o acompanhamento das mensagens, do cumprimento de exigências e dos recursos.
Vale lembrar que o Sistema Solicita permite o carregamento de vários arquivos de até 25MB de forma simultânea. Esses arquivos podem ser de vários tipos (jpg, jpeg, bmp, png, pdf, doc, docx, xls e xlsx). Após a submissão de um arquivo, o usuário pode visualizá-lo no próprio sistema.
Confira também:
Webinar Sistema Solicita: esclareça suas dúvidas e conheça as novidades
Perguntas e respostas sobre o Sistema Solicita
Entenda
A Resolução da Diretoria Colegiada (RDC) 359/2020, que instituiu o Dossiê de Insumo Farmacêutico Ativo (Difa) e a Cadifa, entrou em vigor no dia 3 de agosto de 2020. Nela, está previsto o envio do Difa pelo seu detentor à Anvisa. Isso alterou a dinâmica anterior de registro e pós-registro de medicamentos novos, inovadores, genéricos e similares no Brasil. As novas regras permitem que empresas estrangeiras realizem, diretamente, os procedimentos para emissão da Cadifa, sem a necessidade de intermediação, o que é considerado um marco regulatório.
A fim de facilitar esse processo, a Anvisa elaborou o Manual Cadifa, que orienta o detentor do Difa, por exemplo, a realizar o cadastro da empresa, receber documentos enviados pela Agência e submeter Difa e suas alterações.
Além da RDC 359/2020, está vigente desde 3 de agosto de 2020, a RDC 361/2020, que dispõe sobre a necessidade da Cadifa e da Certificação de Boas Práticas de Fabricação (CBPF) para o registro e o pós-registro de medicamentos. A norma também atualiza a apresentação e o gerenciamento do ciclo de vida dos documentos relacionados aos insumos farmacêuticos ativos, tendo estabelecido um período de transição para o registro e o pós-registro de medicamentos, de acordo com o novo marco regulatório.
Envio direto
Embora já praticado em outros mercados, a nova dinâmica de envio direto da documentação pelo detentor do Difa é um desafio para Anvisa. Essa é a primeira vez em que se permite que uma empresa, sem CNPJ, possa realizar diretamente o peticionamento para aprovação documental e emissão da Cadifa por meio dos sistemas da Anvisa. Outras agências reguladoras, como a dos Estados Unidos e as da Europa, já adotam mecanismo semelhante.
Quer saber mais sobre o assunto? Acesse as perguntas e respostas sobre a RDC 359/2020 e a página da Coordenação de Registro de Insumos Farmacêuticos Ativos (Coifa). Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos, cadifa, difa, rdc 359/2020
Fonte: Site da ANVISA
Read More
Disponível nova versão de Perguntas e Respostas sobre Suplementos Alimentares
Já está disponível a 8ª edição do Perguntas e Respostas (FAQ) sobre Suplementos Alimentares. O documento conta com 178 orientações atualizadas sobre o marco regulatório dos suplementos alimentares.
Nesta edição foram feitas algumas melhorias como o aprimoramento de 27 perguntas e a renumeração das perguntas, a fim de garantir a organização por temas. Também foram realizados ajustes na numeração de algumas normas que foram revisadas e consolidadas, após o Revisaço (Decreto 10.139/2019), e que entraram em vigor no dia 1º de setembro de 2022.
O documento é um instrumento de esclarecimento, não-regulatório, de caráter não-vinculante, destinado unicamente a tirar dúvidas sobre o marco regulatório dos suplementos alimentares. O marco regulatório é formado por Resoluções de Diretoria Colegiada (RDC) e Instruções Normativas (IN).
Clique aqui para acessar a 8ª edição de Perguntas e Respostas (FAQ) sobre Suplementos Alimentares.
Categoria: Saúde e Vigilância Sanitária
Tags: alimentos suplementos alimentares
Fonte: Site da ANVISA
Read More
Fiscalização sanitária: entenda as ações realizadas pela Anvisa
A fiscalização sanitária é uma das formas de realizar o controle de produtos e serviços submetidos à vigilância sanitária. Para esclarecer os questionamentos da sociedade, a Anvisa reúne aqui os principais pontos sobre o tema.
Em primeiro lugar, você sabe de que forma são desencadeadas as ações de fiscalização?
As ações de fiscalização têm início a partir de denúncias, de queixas técnicas e de programas de monitoramento. Na fase inicial do processo de investigação são avaliadas as informações que foram apresentadas e, a depender do caso, solicitados mais subsídios para análise da equipe técnica especializada. Durante esse processo, a Agência pode adotar medidas de controle a fim de eliminar, reduzir ou atenuar os eventuais riscos sanitários.
Existe uma área exclusiva do portal que reúne orientações e informações para o registro de queixas técnicas desses produtos (medicamentos, dispositivos médicos, testes para diagnóstico, alimentos, cosméticos e saneantes) e serviços sujeitos à vigilância sanitária. O cidadão também pode contribuir. Para denúncias, reclamações, sugestões ou críticas, estão disponíveis a Ouvidoria e o Fale Conosco.
Medidas preventivas
Durante o processo de avaliação de um problema sanitário, a Anvisa tem a prerrogativa de adotar medidas com o objetivo de eliminar, reduzir ou atenuar os riscos sanitários associados a produtos ou serviços sujeitos à sua atuação. Essas medidas, chamadas de preventivas, podem determinar ações de fiscalização destinadas a apenas um lote, um número de série do produto ou para todos os lotes do produto e até mesmo para todos os produtos de uma empresa.
Entre as ações de fiscalização, estão a apreensão, o recolhimento, a proibição e a suspensão de armazenamento, comercialização, distribuição, fabricação, importação, propaganda e/ou uso do produto ou serviço. Os efeitos dessas medidas permanecem válidos até que a Agência certifique que o risco foi superado ou que novos fatos comprovem que a medida não é mais necessária. Nesse caso, é revogada a medida de urgência.
Em outras palavras, a medida preventiva é um ato de precaução que visa proteger a saúde da população em caso de risco iminente, sem a prévia manifestação do interessado. Sua aplicação está de acordo com a Lei 6.360/1976; a Lei 9.782/1999; e a Lei 9.784/1999.
Medidas cautelares
As medidas cautelares também são atos administrativos de precaução que visam proteger a saúde da população em caso de risco iminente e sem a prévia manifestação do interessado. A diferença é que esse tipo de medida prevê ações de interdição de produtos ou de estabelecimentos.
A medida cautelar está fundamentada nos termos da Lei 6.437/1977, sendo aplicável para ação de fiscalização de interdição cautelar. A interdição cautelar, por sua vez, se aplica aos casos “em que sejam flagrantes os indícios de alteração ou adulteração do produto”. Ela tem prazo previsto em lei de 90 dias.
Atenção! Tanto as medidas preventivas como as medidas cautelares não são penalidades. Quando aplicadas, não têm caráter condenatório e punitivo. A finalidade delas é evitar a exposição ao consumo e o uso de produtos irregulares ou sob suspeita.
Infração sanitária
Após a finalização da etapa de investigação sanitária e uma vez confirmada a infração, tem início o processo de autuação do responsável.
A autuação é realizada pela Coordenação de Processo Administrativo Sanitário (Copas), unidade organizacional responsável por instaurar Processo Administrativo Sanitário Sancionador (PAS) para apuração de infrações à legislação sanitária federal, de acordo com os procedimentos estabelecidos pela Lei 6.437/1977.
É somente após a conclusão do PAS, sem prejuízo das sanções de natureza civil ou penal cabíveis, que os responsáveis pelas infrações sanitárias serão punidos, alternativa ou cumulativamente, com as penalidades definidas na Lei 6.437/1977.
Quer consultar um produto, distribuidor ou fabricante?
As medidas preventivas e cautelares são adotadas por decisão da Anvisa e publicadas no Diário Oficial da União por meio de Resolução (RE). Elas estão disponíveis na página Consulta de produtos irregulares, aqui em nosso portal.
Após acessar a Consulta de produtos irregulares (para irregularidades identificadas após 2019), é preciso inserir os critérios da consulta e selecionar o produto de interesse. Feito isso, aparecerá uma nova tela com informações da medida, inclusive se a medida está ativa (em vigência) ou se foi revogada.
Outra opção de pesquisa disponível no portal da Anvisa é verificar se determinado produto regularizado na Agência possui alguma medida associada. Para isso, acesse Consulta de produtos regularizados e selecione a categoria de interesse. Se o produto tiver alguma medida preventiva ou cautelar vigente, aparecerá um ícone em vermelho com “Medida Cautelar”. Ao clicar nessa caixa, o usuário será direcionado para a página da respectiva medida, com o detalhamento da ação. Observe abaixo:
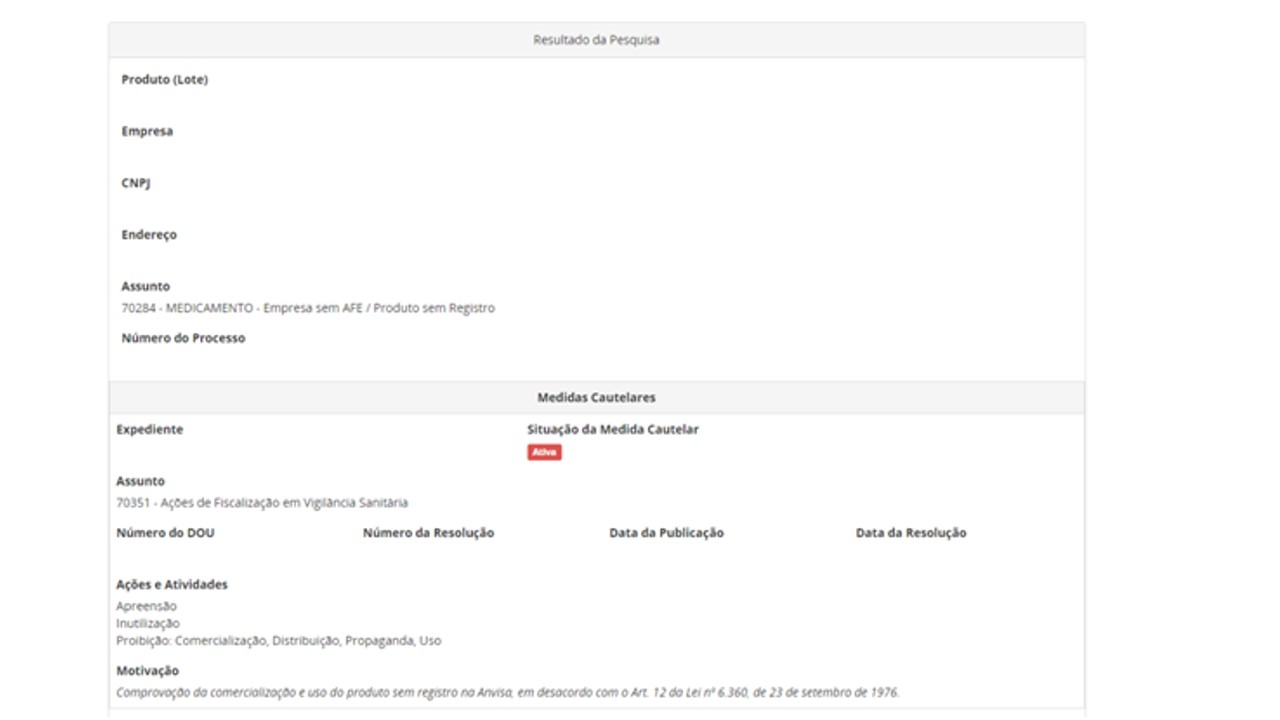
Para consultar se a empresa possui alguma medida preventiva ou cautelar vigente associada, o usuário deve acessar a página de Consultas da Anvisa e selecionar a busca para empresas nacionais, na Consulta de funcionamento de empresas nacionais, ou internacionais, na Consulta de funcionamento de empresas internacionais.
Embora nas páginas de consulta destacadas acima seja mencionada apenas a nomenclatura “Medida Cautelar”, também estão abarcadas as medidas preventivas (além das medidas cautelares). Com o objetivo de imprimir mais transparência e clareza a essas informações, a Anvisa analisa melhorias para a identificação dessas medidas.
As informações referentes ao expediente da medida, número da Resolução, data de publicação, ações de fiscalização e motivação podem ser acessadas por meio das páginas de consulta.
Para detalhamento da fundamentação principal e do tipo da medida, a Resolução que publicou a medida deve ser acessada no Diário Oficial da União.
Na leitura das medidas preventivas e cautelares, é importante observar as atividades às quais ela foi aplicada; o produto a que se refere, podendo ser, por exemplo, apenas um lote ou número de série de um produto ou todos os produtos de determinada empresa; e se a medida se encontra válida (vigente) ou não (neste caso, denominada como revogada).
Histórico de medidas de um produto
Algumas vezes, a Anvisa é questionada sobre a razão de manter o histórico de uma medida cautelar ou preventiva vinculada ao registro de um produto. Explicamos: essas informações fazem parte da política de transparência da Agência. Além disso, elas têm por objetivo auxiliar as atividades de fiscalização das Vigilâncias Sanitárias estaduais e municipais, que, a partir da respectiva publicação, recebem orientação sobre o período em que uma medida está ou esteve vigente.
Diferenciações importantes
A tabela anexa apresenta um resumo das ações adotadas pela Anvisa e suas características.
Tags: fiscalização sanitária, medidas preventivas, medidas cautelares, infrações sanitárias
CONTEÚDO RELACIONADO
Fonte: Site da ANVISA
Read More
Perguntas e respostas sobre recolhimento de alimentos: confira
Está disponível para consulta o documento com perguntas e respostas sobre o recolhimento de alimentos. O objetivo do material é orientar as empresas, o Sistema Nacional de Vigilância Sanitária (SNVS) e a população a respeito dos procedimentos necessários para realizar um recolhimento junto à Anvisa.
O documento conta com 17 perguntas e respostas, que esclarecem desde questões gerais, como as situações em que o recolhimento é necessário, até orientações detalhadas sobre como protocolar os documentos exigidos pela legislação na Agência.
Entenda
O recolhimento de alimentos visa retirar do mercado produtos que representem risco ou agravo à saúde do consumidor. Há dois tipos de recolhimento: o voluntário e o determinado.
O recolhimento voluntário é iniciado pela empresa responsável pelo produto, ao identificar uma situação de risco sanitário. Já o recolhimento determinado é estabelecido pela Anvisa, como medida preventiva de risco ou agravo à saúde do consumidor, caso não seja realizado voluntariamente pela empresa.
Vale observar que é obrigação da empresa interessada realizar o recolhimento de produtos que representem risco ou agravo à saúde do consumidor, imediatamente após a ciência do fato, conforme procedimentos estabelecidos na legislação sanitária.
O recolhimento de alimentos é regulamentado na Anvisa pela Resolução da Diretoria Colegiada (RDC) 655/2022. A RDC 655/2022 foi publicada como resultado da revisão da RDC 24/2015, em atendimento ao Decreto 10.139/2019. Foram realizados apenas ajustes pontuais para adequação da técnica legislativa e atualização da prática do processo eletrônico implementado pela Agência nos últimos anos, garantindo maior previsibilidade.
Acesse o documento de Perguntas & Respostas sobre o recolhimento de alimentos. Categoria
Saúde e Vigilância Sanitária
Tags: alimentos perguntas e respostas recolhimento de alimentos
Fonte: Site da ANVISA
Read More
Concluída a última etapa de avaliação e consolidação de normas da Anvisa
A Diretoria Colegiada (Dicol) da Anvisa aprovou, por unanimidade, o relatório de conclusão da sexta e última etapa do Projeto Regulatório 1.2 – Avaliação e Consolidação de Normas do estoque regulatório da Agência, em cumprimento ao Decreto 10.139, de 28 de novembro de 2019, que trata da revisão e da consolidação dos atos normativos inferiores a decreto editados em âmbito federal.
A última etapa do projeto, deliberada em caráter ad referendum (sujeita a aprovação posterior) no dia 29 de julho, foi referendada pelo colegiado na Reunião Ordinária Pública realizada nesta terça-feira (9/8), e contém a enumeração dos atos normativos da Anvisa que necessitam de alterações mais profundas, inclusive com possibilidade de alterações de mérito do texto normativo.
A lista de 494 atos inclui:
(i) normas com previsão de revisão profunda de mérito e já contempladas na Agenda Regulatória da Anvisa 2021-2023;
(ii) normas com necessidade de revisão de mérito, mas não contempladas na Agenda 2021-2023; e
(iii) normas com técnica legislativa ou redação defasada e que necessitam de ampla revisão de forma.
Esses processos seguirão as diretrizes e os procedimentos regulatórios usuais para a edição de regulamentos na Agência, estabelecidos pela Portaria 162/2021.
Resultados gerais do projeto de avaliação e consolidação de normas
O projeto de avaliação e consolidação de normas foi iniciado em fevereiro de 2020, logo após a publicação do Decreto 10.139/2019, e foi desenvolvido em cinco etapas temáticas, com entregas em novembro de 2020, fevereiro, maio e agosto de 2021 e março de 2022, além dessa etapa final de publicação da lista de normas com necessidade de revisão mais profunda.
Ao longo do ciclo 2020-2022 de avaliação e consolidação das normas da Anvisa, foi feita a triagem de 1932 atos normativos, sendo que 1915 normas vigentes foram efetivamente avaliadas. Das normas avaliadas, 1155 foram revogadas, sendo que 853 delas foram permanentemente retiradas do estoque regulatório da Agência e 339 foram consolidadas em novos atos normativos adequados ao Decreto. Outros 742 atos permaneceram vigentes, sem a necessidade de adequações, e 187 atos normativos consolidados foram publicados.
Assim, o atual estoque regulatório da Anvisa contempla 929 atos normativos vigentes, o que representa uma redução de quase 50% do volume inicial de normas selecionadas, representando uma importante redução e simplificação da regulamentação sanitária editada pela Agência.
Os dados do projeto de avaliação e consolidação de normas podem ser consultados no relatório final, que apresenta os Resultados Gerais das ações para atendimento ao Decreto 10.139/2019 – Ciclo 2020-2022. Categoria
Saúde e Vigilância Sanitária
Tags: regulação aprimoramento simplificação avaliação de normas consolidação de normas redução do estoque regulatório
Fonte: Site da ANVISA
Read More
Acompanhe a 14ª Reunião da Diretoria Colegiada da Anvisa
A Anvisa realiza, a partir das 10h30 desta terça-feira (9/8), a 14ª Reunião Ordinária Pública da Diretoria Colegiada de 2022. O encontro dos diretores será realizado por meio de videoconferência e pode ser acompanhado ao vivo pelo canal da Agência no YouTube.
Na pauta, estão propostas de aberturas de processo regulatório sobre critérios e procedimentos temporários e excepcionais para importação de radiofármacos; sobre procedimentos temporários e extraordinários para avaliação abreviada das petições de registro e alterações ou mudanças pós-registro de medicamentos e produtos biológicos; e sobre a realização de ensaios clínicos com dispositivos médicos no Brasil.
Também está prevista a análise de proposta de consulta pública para Resolução de Diretoria Colegiada (RDC) que dispõe sobre a regularização de alimentos e embalagens sob competência do Sistema Nacional de Vigilância Sanitária (SNVS) destinados à oferta no território nacional.
Veja aqui a pauta completa e abaixo um resumo de outros temas previstos para a reunião:
- Proposta de abertura de processo regulatório para simplificar os requisitos referentes à apresentação de metodologias e acreditação laboratorial previstos na RDC 559, de 30 de agosto de 2021 – Registro de produtos fumígenos derivados do tabaco.
- Proposta de abertura de processo regulatório sobre a importação de bens e produtos sujeitos à vigilância sanitária por meio de Declaração Única de Importação.
- Apresentação de relatório de Análise de Impacto Regulatório (AIR) sobre procedimentos para regularização de alimentos e embalagens.
- Apresentação de relatório de Análise de Impacto Regulatório sobre a regularização da doação de alimentos com segurança sanitária.
Data: 9/8/2022.
Horário: 10h30.
Local: a reunião será realizada por meio de videoconferência.
Acompanhe a reunião pelo link abaixo: https://www.youtube.com/embed/0YAxYPeT44U
Categoria
Saúde e Vigilância Sanitária
Tags: dicol reunião da diretoria colegiada
Fonte: Site da ANVISA
Read More
Atualizada lista de Denominações Comuns Brasileiras
A Anvisa publicou a Resolução da Diretoria Colegiada (RDC) 733/2022, que atualiza a lista das Denominações Comuns Brasileiras (DCBs).
Foram incluídas 11 novas denominações e foi alterada uma DCB. Nesta atualização, foi alterada a DCB da espinheira-santa, de Maytenus ilicifolia Mart. ex Reissek para Monteverdia ilicifolia (Mart. ex Reissek) Biral.
A lista consolidada das DCBs está disponível em uma página específica do portal. Clique aqui e confira. Nesse espaço, você encontrará também outras informações relacionadas ao tema, tais como legislação, manual e formulários para inclusão, alteração e exclusão de denominações.
Saiba mais
Denominação Comum Brasileira (DCB) é a denominação do fármaco ou princípio ativo aprovada pelo órgão federal responsável pela vigilância sanitária (Lei 9.787/1999). Atualmente, com o registro eletrônico, adquiriu um conceito mais amplo e inclui também a denominação de insumos inativos, soros hiperimunes e vacinas, radiofármacos, plantas medicinais, substâncias homeopáticas e biológicas. Categoria
Saúde e Vigilância Sanitária
Tags: farmacopeia denominação comum brasileira DCB lista de DCBs espinheira-santa
Read More
Rotulagem nutricional: novas regras entram em vigor em 75 dias
As novas regras para rotulagem de alimentos entram em vigor no dia 9 de outubro de 2022. Além de mudanças na tabela de informação e nas alegações nutricionais, a novidade será a adoção da rotulagem nutricional frontal.
Rotulagem nutricional frontal
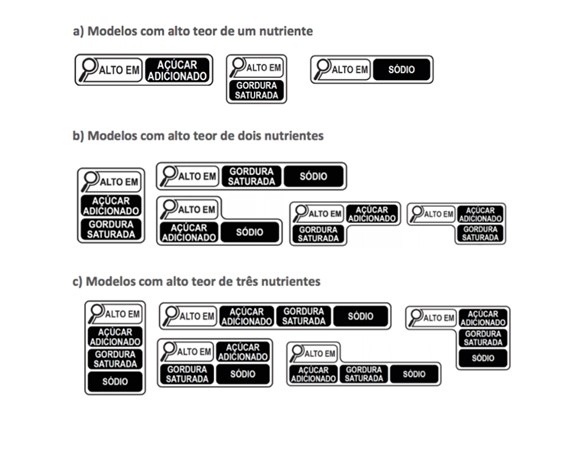
Considerada a maior inovação das novas regras, a rotulagem nutricional frontal é um símbolo informativo que deve constar no painel da frente da embalagem. A ideia é esclarecer o consumidor, de forma clara e simples, sobre o alto conteúdo de nutrientes que têm relevância para a saúde.
Para tal, foi desenvolvido um design de lupa para identificar o alto teor de três nutrientes: açúcares adicionados, gorduras saturadas e sódio. O símbolo deverá ser aplicado na face frontal da embalagem, na parte superior, por ser uma área facilmente capturada pelo nosso olhar.
É obrigatória a veiculação do símbolo de lupa com indicação de um ou mais nutrientes, conforme o caso, quando os alimentos apresentarem as seguintes quantidades de nutrientes:
| Alto conteúdo de | Alimentos sólidos e semissólidos | Alimentos líquidos |
| Açúcar adicionado | 15 g ou mais por 100 g de alimento | 7,5 g ou mais por 100 ml de alimento |
| Gordura saturada | 6 g ou mais por 100 g de alimento | 3 g ou mais por 100 ml de alimento |
| Sódio | 600 mg ou mais por 100 g de alimento | 300 mg ou mais por 100 ml de alimento |
Confira os modelos:
Clique aqui para conhecer todas as mudanças na rotulagem de alimentos.
O que dizem os outros atores
Como recordar é viver, registramos a seguir manifestações que denotam a alta relevância dessas novas regras no empoderamento dos consumidores e na promoção de hábitos alimentares mais saudáveis.
- Fundo das Nações Unidas para a Infância (Unicef)
“A rotulagem frontal não impede o consumo desses alimentos, mas traz informação adequada e de fácil visualização que pode apoiar os pais e as próprias crianças a fazerem escolhas mais saudáveis e conscientes, se assim desejarem.” Stephanie Amaral Bispo – Unicef, out. 2020.
- Organização Pan-Americana da Saúde (Opas/OMS)
“Parabenizamos a Anvisa pela excelência e pela transparência na condução do processo regulatório da rotulagem nutricional… a Opas e a OMS recomendam a rotulagem nutricional frontal para prevenir e controlar a obesidade e as doenças crônicas relacionadas à alimentação.” Luisete Moraes Bandeira – Opas/OMS, out. 2020.
- Ministério da Saúde do Brasil
“A má nutrição é hoje o principal fator que impacta na carga global de doenças dos brasileiros e, como consequência, temos a obesidade e o excesso de peso como as condições mais prevalentes associadas à alimentação inadequada… uma das estratégias efetivas para melhorar a alimentação dos brasileiros e prevenir a incidência de doenças é garantir a informação adequada, que permita uma rápida comparação entre os alimentos… no momento que as informações são mais claras e se permitem as escolhas, isso contribui para a nutrição e a saúde da população brasileira.” Gisele Bortolini, coordenadora-geral de Alimentação do Ministério da Saúde, out. 2020.
- Universidade Federal de Santa Catarina (UFSC)
“Venho aqui defender especificamente a inclusão de alertas relacionados a nutrientes críticos no painel frontal dos rótulos, pois esses alertas têm enorme potencial para auxiliar os consumidores a tomarem decisões.” Rossana Pacheco Proença – Núcleo de Pesquisa de Nutrição em Produção de Refeições (Nuppre/UFSC), out. 2020.
“Após seis anos de ampla participação social, que envolveu toda a sociedade, entendemos que conseguimos alcançar um nível suficiente e robusto de evidências e argumentações que embasem uma decisão comprometida com a saúde.” Vanessa Rodrigues – Nuppre/UFSC, out. 2020.
- Instituto Brasileiro de Defesa do Consumidor (Idec)
“Um dos pilares do direito do consumidor é o direito à informação, para que os consumidores tenham a exata noção daquilo que estão consumindo e possam exercer a sua liberdade de escolha. Por essa razão, esse processo regulatório de revisão de regras de rotulagem nutricional que a Anvisa vem conduzindo é certamente um dos processos mais relevantes para a consolidação de direitos dos consumidores desde 1990, ano de surgimento do Código de Defesa do Consumidor.” Igor – Idec, out. 2020.
- Conselho Federal de Nutricionistas (CFN)
“Após seis anos de ampla participação social, que envolveu toda a sociedade, entendemos que conseguimos alcançar um nível suficiente e robusto de evidências e argumentações que embasem uma decisão comprometida com a saúde.” Luiza Torquato – CFN, out. 2020.
- ACT Promoção da Saúde
“É chegada a hora de a gente adotar essa medida importantíssima que faz parte de um conjunto de medidas para melhorar os indicadores relativos a doenças crônicas no Brasil.” Paula Johns – ACT Promoção da Saúde, out. 2020.
- Põe no Rótulo
“Se não testou todos, foram quase todos os mecanismos possíveis de diálogo e interação com as partes relacionadas… vale lembrar que a efetiva liberdade de escolha dos consumidores depende do acesso às informações que falem a língua dos consumidores e que lhes permitam comparar produtos de diferentes categorias.” Cecília Cury – Põe no Rótulo, out. 2020.
- Associação Brasileira da Indústria de Alimentos (Abia)
“Defende a adoção de modelo informativo de rotulagem nutricional que ofereça ao consumidor as melhores informações de que necessita para fazer as escolhas alimentares, de acordo com as suas características, preferências individuais e o contexto de dieta equilibrada.” João Dornellas – Abia, out. 2020.
Saiba mais
A Anvisa disponibiliza em seu portal as seguintes ferramentas que podem esclarecer dúvidas em relação às novas regras de rotulagem nutricional:
- Documento de perguntas e respostas sobre rotulagem nutricional.
- Webinares sobre tabela de informação nutricional, rotulagem nutricional frontal e alegações nutricionais.
Caso essas informações não sejam suficientes, os interessados podem entrar em contato com a Central de atendimento da Anvisa, onde há opção de atendimento por telefone, webchat ou formulário eletrônico. Categoria
Saúde e Vigilância Sanitária
Tags: alimentos rotulagem de alimentos rotulagem nutricional frontal novas regras alegações nutricionais saúde do consumidor
Fonte: Site da ANVISA
Read More
Anvisa informa sobre indisponibilidade de sistemas
A Anvisa informa que detectou uma degradação de seus sistemas de informação e da rede interna, o que impacta diretamente a disponibilidade de serviços como o Solicita, Siptox, Sammed, Sisgap, Peticionamento, PEI, UniGRU, Civnet, Consultas Externas, SNGPC, Notivisa, Parlatório, entre outros.
A atuação sobre os problemas encontrados começou de imediato e segue com prioridade altíssima pela equipe responsável. Até que os problemas sejam solucionados, os usuários poderão encontrar dificuldades de acesso aos sistemas.
Um novo comunicado será emitido quando os serviços forem restabelecidos.
Fonte: Site da ANVISA
Read More
Regulação de alimentos: consolidação de atos normativos
Em continuidade ao processo de revisão e consolidação de atos normativos, foram publicadas, no Diário Oficial da União (D.O.U.) desta quarta-feira (6/7), 18 Resoluções da Diretoria Colegiada (RDC) e quatro Instruções Normativas (IN) relacionadas à regulação de alimentos. Esses 22 atos substituem 51 regulamentos que foram revogados. Os novos atos entrarão em vigor no dia 1º de setembro, exceto a RDC 729/2022, cuja vigência terá início em 9 de outubro.
Todas as alterações realizadas têm como objetivo aprimorar a redação e a forma dos atos normativos, de modo a imprimir mais clareza, sem alterar o mérito dos conteúdos. Ou seja, não foi realizada nenhuma alteração dos requisitos atualmente aplicados aos produtos abrangidos pelos regulamentos.
Resoluções publicadas: entenda
RDC 711/2022: Dispõe sobre os requisitos sanitários dos amidos, biscoitos, cereais integrais, cereais processados, farelos, farinhas, farinhas integrais, massas alimentícias e pães. Resultado da revisão da RDC 236/2005.
RDC 712/2022: Dispõe sobre os requisitos de composição e rotulagem dos alimentos contendo cereais e pseudocereais para classificação e identificação como integral e para destaque da presença de ingredientes integrais. Resultado da revisão da RDC 493/2021.
RDC 713/2022: Dispõe sobre os requisitos sanitários dos gelados comestíveis e dos preparados para gelados comestíveis. Resultado da revisão da RDC 266/2005.
RDC 714/2022: Dispõe sobre os requisitos sanitários para enriquecimento e restauração de alimentos. Resultado da revisão da Portaria SVS/MS 31/1998.
RDC 715/2022: Dispõe sobre os requisitos sanitários do sal hipossódico, dos alimentos para controle de peso, dos alimentos para dietas com restrição de nutrientes e dos alimentos para dietas de ingestão controlada de açúcares. Resultado da revisão e consolidação das Portarias SVS/MS 54/1995; SVS/MS 29/1998; SVS/MS 30/1998 e das RCDs 135/2017 e 155/2017.
RDC 716/2022: Dispõe sobre os requisitos sanitários do café, cevada, chás, erva-mate, especiarias, temperos e molhos e IN 159/2022, que estabelece as listas das partes de espécies vegetais autorizadas para o preparo de chás e para o uso como especiarias, resultantes da revisão e consolidação das RDCs 267/2005; 276/2005; 277/2005, 219/2006 e arts. 2º e 3º e Anexos I e II da RDC 450/2020.
RDC 717/2022: Dispõe sobre os requisitos sanitários das águas envasadas e do gelo para consumo humano. Resultado da revisão e consolidação das RDCs 274/2005 e 316/2019.
RDC 719/2022: Dispõe sobre os requisitos sanitários das misturas para o preparo de alimentos e dos alimentos prontos para o consumo. Resultado da revisão da RDC 273/2005.
RDC 720/2022: Dispõe sobre os requisitos sanitários dos alimentos nutricionalmente modificados. Resultado da revisão RDC 3/2013.
RDC 722/2022: Dispõe sobre os limites máximos tolerados (LMT) de contaminantes em alimentos, os princípios gerais para o seu estabelecimento e os métodos de análise para fins de avaliação de conformidade, como resultado da revisão da RDC 487/2021 e IN 160/2022, que estabelece os limites máximos tolerados (LMT) de contaminantes em alimentos, como resultado da revisão e consolidação das INs 88/2021, 115/2021 e 152/2022.
RDC 723/2022: Dispõe sobre os requisitos sanitários do açúcar, açúcar líquido invertido, açúcar de confeitaria, adoçante de mesa, bala, bombom, cacau em pó, cacau solúvel, chocolate, chocolate branco, goma de mascar, manteiga de cacau, massa de cacau, melaço, melado e rapadura. Resultado da revisão e consolidação da Resolução CNNPA 3/1976 e das RDCs 264/2005; 265/2005; 271/2005 e 450/2020.
RDC 724/2022: Dispõe sobre os padrões microbiológicos dos alimentos e sua aplicação, como resultado da revisão da RDC 331/2019 e IN 161/2022, que estabelece os padrões microbiológicos dos alimentos, resultante da revisão e consolidação das INs 60/2019; 79/2020 e 110/2021.
RDC 725/2022: Dispõe sobre os aditivos alimentares aromatizantes. Resultado da revisão e consolidação da RDC 2/2007 e da IN 15/2017.
RDC 726/2022: Dispõe sobre os requisitos sanitários dos cogumelos comestíveis, dos produtos de frutas e dos produtos de vegetais. Resultado da revisão e consolidação das RDCs 17/1999; 91/2000; 268/2005; 272/2005 e 85/2016.
RDC 727/2022: Dispõe sobre a rotulagem dos alimentos embalados. Resultado da revisão e consolidação das RDCs 259/2002; 123/2004; 340/2002; 35/2009; 26/2015; 136/2017; 459/2020 e IN 67/2020.
RDC 728/2022: Dispõe sobre as enzimas e as preparações enzimáticas para uso como coadjuvantes de tecnologia na produção de alimentos destinados ao consumo humano. Resultado da revisão e consolidação das RDCs 53/2014 e 54/2014.
RDC 730/2022: Dispõe sobre a avaliação do risco à saúde humana de medicamentos veterinários, os limites máximos de resíduos (LMR) de medicamentos veterinários em alimentos de origem animal e os métodos de análise para fins de avaliação da conformidade, como resultado da revisão da RDC 328/2019 e IN 162/2022, que estabelece a ingestão diária aceitável (IDA), a dose de referência aguda (DRfA) e os limites máximos de resíduos (LMR) para insumos farmacêuticos ativos (IFA) de medicamentos veterinários em alimentos de origem animal, resultante da revisão e consolidação das INs 51/2019; 89/2021 e 117/2022.
Foi publicada também a RDC 729/2022, que dispõe sobre a melhoria da técnica legislativa e revogação de normas inferiores a decreto editadas pela Anvisa, componentes da quinta etapa de consolidação da pertinência temática de alimentos, em observância ao que prevê a Portaria 488/GADIP-DP/Anvisa, de 23 de setembro de 2021, e o Decreto 10.139/2019. Vale lembrar que as alterações pontuais promovidas pela RDC 729/2022 não modificam o mérito das normas afetadas, visando apenas manter a consistência normativa com outras alterações que foram realizadas como parte do processo de revisão e consolidação.
A RDC 729/2022 entrará em vigor em 9 de outubro de 2022, porque incorpora alterações sobre a rotulagem nutricional de alimentos embalados, alterações essas que entrarão em vigor na respectiva data.
Em caso de dúvidas ou para saber mais, acesse Avaliação e consolidação de normas.
Fonte: Site da ANVISA
Read More
