
Inclusão de informações no SNGPC voltará a ser obrigatória
A Anvisa informa que a inclusão de informações no Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC) voltará a ser obrigatória no primeiro semestre de 2025. O cronograma de retorno será publicado no site da Anvisa no momento oportuno.Os usuários do sistema (profissionais de farmácias e drogarias) têm até 31 de dezembro para testar a ferramenta e tirar possíveis dúvidas.
O SNGPC passou por atualizações para corrigir problemas pontuais e aprimorar a inserção de dados e informações. Vale lembrar que a inclusão das informações no SNGPC não precisa ser feita no ato da venda do medicamento. A farmácia ou drogaria tem até sete dias para realizar a ação.
Entenda
No início de outubro, a Anvisa divulgou o cronograma da etapa de atualização de cadastros e convidou as farmácias privadas a participarem do teste.
A adesão das farmácias, neste momento, é essencial para que os ajustes necessários sejam realizados e embasem o futuro retorno do sistema com robustez e estabilidade. As transmissões realizadas durante toda a etapa dos testes, compreendendo os conteúdos de arquivos, a periodicidade e quaisquer outros elementos a ela relacionados, não irão configurar, exclusivamente durante essa fase, base para fiscalizações dos órgãos competentes.
Durante o período de testes – e após – deve ser mantida a escrituração da movimentação nos sistemas ou registros internos, para fins de comprovação de estoque e fiscalização, conforme estabelece a Resolução da Diretoria Colegiada (RDC) 586/2022. Além disso, o prazo de guarda documental previsto na Portaria SVS/MS 344/1998 e na RDC 22/2014 permanece o mesmo.
Vídeos de treinamento
A Anvisa disponibilizou vídeos explicativos sobre o SNGPC. Ao todo, são quatro vídeos: (1) O que é o SNGPC?; (2) Cadastro e credenciamento; (3) Funções do sistema; e (4) Dúvidas e perguntas frequentes.
Para mais informações, acesse as orientações para os testes.
Leia também:
Agência irá ampliar testes do Sistema Nacional de Gerenciamento de Produtos ControladosCategoria
Saúde e Vigilância Sanitária
Tags: SNGPC medicamentos produtos controlados
Fonte: Site da ANVISA
Read More
Participe do Seminário Cadifa 2024
A Anvisa irá realizar, no dia 19 de novembro, o Seminário Cadifa 2024, e você é nosso convidado!
O encontro tem como objetivo discutir pontos importantes do novo marco regulatório de insumos farmacêuticos ativos (IFAs). Serão abordados temas relacionados à Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (Cadifa) e ao Certificado de Boas Práticas de Fabricação (CBPF) de IFA, bem como à apresentação desses documentos no registro e no pós-registro de medicamentos.
O seminário será realizado em Brasília (DF), na sede do Conselho Federal de Farmácia, e terá transmissão e tradução simultâneas.
Seminário Cadifa 2024
Local: sede do Conselho Federal de Farmácia, em Brasília (DF).
Horário: das 9h às 16h30.
Inscrições
Para participação presencial, a inscrição deverá ser feita até as 18h do dia 10/11, por meio deste formulário eletrônico. Já os interessados em participar remotamente devem inscrever-se por este formulário.
Programação preliminar
9h – 9h30: Café de boas-vindas e credenciamento.
9h30 – 10h: Abertura – Representantes da Anvisa e associações.
10h – 12h: Atualizações relacionadas à Cadifa – representante da Coordenação de Registro de Insumos Farmacêuticos Ativos (Coifa).
12h – 13h30: Brunch.
13h30 – 14h30: Atualizações sobre o uso de Cadifa em registro e pós-registro de medicamentos – representante da Gerência de Avaliação da Qualidade de Medicamentos Sintéticos (GQMED).
14h30 – 15h: Atualizações sobre CBPF de IFA – representante da Coordenação de Inspeção e Fiscalização Sanitária de Insumos Farmacêuticos (Coins).
15h – 16h30: Perguntas e respostas.
Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos insumos farmacêuticos ativos ifas cadifa seminário cadifa
Fonte: Site da ANVISA
Read More
Conheça o novo painel de acompanhamento de normas da CMED
Está disponível para consulta o Painel de Atos Normativos da Câmara de Regulação do Mercado de Medicamentos – CMED. A ferramenta permite acessar, de forma qualificada, informações sobre o conjunto de regulamentos sob responsabilidade da CMED.
O painel permite visualizar e consultar a lista de todas as normas da CMED, com informações detalhadas sobre cada uma, inclusive com o link para acesso direto ao seu texto completo. Por meio de filtros intuitivos, ainda é possível personalizar a consulta, de acordo com o interesse do usuário.
Pode-se consultar, por exemplo, o quantitativo de normas vigentes ou as normas que tratam sobre reajuste anual de preços de medicamentos.
A publicação do painel é mais uma estratégia visando a transparência das informações sobre o estoque regulatório da CMED.
A ferramenta será atualizada sempre que houver a publicação de novo ato normativo pela CMED, instituindo, assim, um processo dinâmico e sistemático de organização e acompanhamento das normas.
As dúvidas ou sugestões sobre o painel podem ser encaminhadas para o e-mail cmed@anvisa.gov.br.
Acesse o Painel de Atos Normativos da CMED.
Categoria
Saúde e Vigilância Sanitária
Tags: CMED atos normativos painel
Fonte: Site da ANVISA
Read More
Anvisa aprova projeto-piloto para bula digital de medicamentos
Os diretores da Anvisa aprovaram, na reunião pública desta quarta-feira (10/7), um projeto-piloto para implementação da bula digital de medicamentos no Brasil.
Segundo o diretor relator, Daniel Pereira, a proposta caminha na direção da modernização e da transformação digital no setor da saúde, e está alinhada com uma tendência mundial. “Essa é uma oportunidade para aprimorar a acessibilidade e a personalização das informações de saúde”, afirmou. De acordo com o relator, não haverá nenhuma redução de direitos aos consumidores. Veja o voto completo do diretor.
O projeto terá vigência até 31 de dezembro de 2026. As informações coletadas e monitoradas durante esse período devem servir como subsídio para a futura regulamentação definitiva sobre o tema.
O que é a bula digital?
A bula digital é uma versão eletrônica da bula de medicamento. Ela pode ser acessada pela leitura, nas embalagens, de um código de barras bidimensional (QR Code). A bula digital também permite o acesso a informações adicionais, como vídeos, áudios e outras instruções que ajudem no uso adequado do medicamento.
Para quais tipos de medicamentos a bula digital será permitida?
| Tipo de medicamento | Justificativa resumida |
| Embalagens de amostras grátis de medicamentos | A entrega das amostras grátis só pode ser feita pelo profissional de saúde ao paciente durante consulta, com a devida prescrição de uso e orientações pertinentes a cada tratamento. |
| Medicamentos com destinação a estabelecimentos de saúde, exceto farmácias e drogarias | De venda permitida em hospitais, clínicas, ambulatórios e serviços de atenção domiciliar, por exemplo, foram selecionados por serem utilizados sob supervisão de profissionais de saúde. |
| Medicamento isento de prescrição (MIP), comercializados em embalagens múltiplas | São produtos de baixo risco e que, segundo a legislação atual, já podem ser disponibilizados nas gôndolas das farmácias, em embalagens primárias (por exemplo, blister ou cartela de comprimidos), sem o acompanhamento de bulas. Caso o consumidor queira a bula física, pode solicitar ao estabelecimento. |
| Medicamentos com destinação governamental, acondicionados em embalagens que contenham as marcas governamentais próprias do Ministério da Saúde | A legislação vigente já isenta, em um grande percentual, a obrigatoriedade de bulas impressas nas embalagens. Da mesma forma que os MIPs, já existe redução considerável na disponibilização de bula física, nos termos da RDC 769, de 12 de dezembro de 2022. |
E a bula impressa, como fica?
Em todos os casos, as bulas impressas devem ser oferecidas caso sejam solicitadas pelos pacientes ou profissionais de saúde.
A norma aprovada prevê também que os estabelecimentos que comercializam medicamentos informem aos consumidores, em comunicação visual, a possibilidade de solicitar a bula impressa, com a frase abaixo:
“Atenção: Este estabelecimento dispensa medicamentos com bula digital! Você pode acessá-la online. Caso prefira, solicite a bula impressa a um de nossos atendentes.”
Veja aqui a sugestão do modelo de cartaz.
Saiba mais
A discussão sobre a bula digital surgiu a partir da publicação da Lei 14.388/22, que prevê que a autoridade sanitária pode definir quais medicamentos terão apenas um formato de bula.
A proposta aprovada pela Anvisa passou por consulta pública em 2023. Todos os materiais relacionados podem ser acessados na página da Consulta Pública 1.224/2023. Veja abaixo o histórico completo do processo regulatório:
- 2022: Inclusão do tema na Agenda Regulatória 2024-2025: Tema 8.29 – Revisão das regras para elaboração, harmonização, atualização, publicação e disponibilização de bulas de medicamentos para pacientes e para profissionais de saúde.
- 2022: Abertura do processo regulatório para discussão sobre a implementação da bula digital e outras informações eletrônicas.
- 2023: Consulta pública aprovada em 6/12/2023 e realizada de 20/12/2023 a 19/3/2024.
- 2024: Deliberação sobre a proposta de resolução em reunião pública da Diretoria Colegiada da Anvisa.
Confira o texto da RDC publicado no Diário Oficial da União desta sexta-feira (12/7). Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos projeto-piloto bula digital
Fonte: Site da ANVISA
Read More
Anvisa aprova novo regulamento para registro de medicamentos biossimilares
A Anvisa aprovou, na reunião da Diretoria Colegiada desta segunda-feira (27/5), o novo regulamento para registro de medicamentos biossimilares.
O objetivo da nova norma é simplificar o processo de desenvolvimento desses produtos, a partir da flexibilização segura de requisitos. O regulamento irá possibilitar a dispensa de algumas etapas e estudos específicos, quanto tecnicamente viável, promovendo assim um ambiente regulatório transparente e previsível ao setor.
Os pontos e requisitos para a comprovação da comparabilidade entre os produtos foram exaustivamente discutidos durante o processo regulatório. Uma das novidades do novo regulamento é a possibilidade de utilização de medicamento de referência comparador adquirido em território internacional em situação de indisponibilidade e comprovados os requisitos técnicos necessários.
A norma hoje aprovada traduz o reconhecimento da Anvisa à importância do acesso dos pacientes aos produtos biológicos, já que a utilização dos biossimilares é uma estratégia de saúde pública importante para diminuir os custos dos medicamentos e aumentar a acessibilidade aos produtos biológicos e às novas tecnologias, com segurança e eficácia.
Processo regulatório
A nova regulamentação é resultado de estudos iniciados em 2022, com a publicação do Edital de Chamamento 15/2022, que colheu importantes informações e subsídios para o desenvolvimento de produtos biológicos pela via da comparabilidade.
Após o Edital, a Anvisa realizou um Diálogo Setorial com a sociedade civil, em 31 de julho do ano passado, que permitiu mais uma coleta de informações para a abertura do processo regulatório.
A norma foi construída de forma transparente, com grande participação da sociedade civil nas discussões desde o início do processo, por meio do Edital de Chamamento, Diálogo Setorial e Consulta Pública, etapas essenciais para o entendimento e a melhoria da proposta regulatória.
A Anvisa é uma das primeiras agências reguladoras a adequar o marco regulatório harmonizado internacionalmente com as principais agências reguladoras do mundo. A nova regra é resultado de um movimento mundial de adequação do marco regulatório para biossimilares, que teve sua importância ressaltada por todos os diretores da Agência para a ampliação do acesso a medicamentos biológicos.
Veja o voto da diretora supervisora Meiruze de Sousa Freitas.
Veja o voto do diretor relator Antonio Barra Torres.
Fonte: Site da ANVISA
Read More
Anvisa aprova Sistema Nacional de Controle de Receituário
A Diretoria Colegiada da Anvisa aprovou, nesta segunda-feira (27/5), uma norma que institui o Sistema Nacional de Controle de Receituário (SNCR).
O objetivo da medida é aprimorar a concessão e o controle das numerações das Notificações de Receita utilizadas para a prescrição de medicamentos e produtos sujeitos a controle especial (medicamentos controlados).
Como o sistema irá funcionar?
A Anvisa irá disponibilizar, para as autoridades sanitárias (Vigilâncias Sanitárias), uma plataforma on-line que irá fornecer uma numeração que deve ser utilizada nas Notificações de Receita pelos prescritores.
A numeração virá de um banco único para todo o país. Isso porque, desde a publicação da Lei 13.732/2018, as receitas passaram a ter validade em todo o território nacional, independentemente da unidade da federação em que tenham sido emitidas.
As Vigilâncias Sanitárias continuarão responsáveis pela concessão e pelo controle das numerações, como já é feito atualmente. Agora, porém, será possível contar com o auxílio da ferramenta on-line para gerenciar os números de forma automatizada, a partir de um banco único nacional.
O SNCR irá aprimorar o controle sobre os receituários e numerações, uma vez que será possível identificar a origem de todas as notificações de receita. A medida irá trazer mais segurança ao farmacêutico no momento da dispensação do medicamento e evitar a ocorrência de fraudes e falsificações.
Atenção: o sistema não será uma plataforma de emissão de prescrições eletrônicas, mas apenas de fornecimento e controle da numeração.
Desenvolvimento e cronograma
O sistema foi desenvolvido e testado com a participação de representantes de autoridades sanitárias indicados pelo Grupo de Trabalho da Vigilância Sanitária, coordenado pela Anvisa. Além disso, a proposta de norma passou pela Consulta Pública 588/2018, além de consultas dirigidas junto ao Sistema Nacional de Vigilância Sanitária (SNVS).
Assim que o SNCR for disponibilizado pela Agência, as autoridades sanitárias que desejarem poderão começar a utilizá-lo para a emissão de novas numerações, ou seja, ainda em 2024. A partir de 1º de janeiro de 2025, o uso do sistema será obrigatório para todas as Vigilâncias Sanitárias.
Para a implementação do SNCR, a Anvisa irá realizar treinamentos e capacitações junto às Vigilâncias Sanitárias estaduais e do Distrito Federal (DF), por meio de webinares e reuniões específicas, além da publicação de um manual sobre o tema no portal da Agência.
Os talonários de receituários impressos até 1º de janeiro de 2025 que não contenham a numeração emitida pelo SNCR poderão ser entregues pela autoridade sanitária competente por até dois anos. Ou seja, haverá um prazo de transição para a substituição gradual das numerações emitidas por cada estado e pelo DF pela numeração única fornecida pelo SNCR.
Neste momento, não há modificações dos procedimentos para os prescritores solicitarem suas numerações ou talonários de Notificação de Receita. Assim, devem ser seguidos os mesmos procedimentos já estabelecidos nas Portarias SVS/MS 344/1998 e 06/1999, e nas orientações complementares definidas pelas Vigilâncias Sanitárias locais.
Sobre os produtos controlados
A Portaria SVS/MS 344/1998 é a norma sanitária que dispõe sobre as medidas de controle para substâncias entorpecentes, precursoras, psicotrópicas e outras sob controle especial. São consideradas substâncias sujeitas a controle especial no Brasil aquelas listadas no Anexo I da referida Portaria. A legislação sanitária estabelece diferentes tipos de receituários controlados aplicáveis aos medicamentos, a depender da sua classificação na norma em questão.
Compete aos estados, aos municípios e ao Distrito Federal exercer a fiscalização e o controle dos atos relacionados à produção, à comercialização e ao uso das substâncias constantes das Listas da Portaria SVS/MS 344/1998, bem como dos medicamentos que as contenham, no âmbito de seus territórios, e, ainda, fazer cumprir as determinações da legislação federal pertinente e da Portaria.
A autoridade sanitária local é responsável por fornecer ao profissional ou instituição hospitalar, devidamente cadastrado, o talonário de Notificação de Receita A (NRA) e o talonário de Notificação de Receita Especial para Talidomida, e a numeração para a confecção dos talonários de Notificação de Receita B e B2 e de Notificação de Receita Especial para Retinoides de uso sistêmico.
A necessidade de controle destes medicamentos e dos receituários se justifica pelos riscos apresentados por essas substâncias, visto que a Portaria abrange substâncias psicoativas, analgésicas, anestésicas, teratogênicas, entre outras. Além disso, devido às suas propriedades, tais medicamentos apresentam potencial de causar dependência e de serem utilizados de forma abusiva ou indevida. Devido a essas características, é importante que os prescritores sejam conhecidos pelas autoridades sanitárias e que os receituários possuam rastreabilidade.
Outra razão para que haja esse controle é que essas substâncias e medicamentos apresentam alto potencial de desvio para uso ilícito, motivo pelo qual se enquadram no conceito de droga definido pela Lei 11.343/2006, que estabelece normas para repressão à produção não autorizada e ao tráfico ilícito de drogas, entre outras.
Categoria
Saúde e Vigilância Sanitária
Fonte: Site da ANVISA
Read More
Esclarecimentos sobre a transparência das filas de análise na Anvisa
Aumento no volume de processos priorizados tem impactado as filas.
Recentemente, a área de Medicamentos da Anvisa recebeu alguns questionamentos sobre o ritmo das filas de análise de medicamentos genéricos e similares. Em resposta, a Agência reitera seu compromisso primordial de garantir a segurança, a eficácia e a qualidade dos produtos submetidos à sua análise.
Destaca-se o contínuo esforço para aprimorar os sistemas e procedimentos da Anvisa, visando mais eficiência e transparência em suas atividades. Como exemplo, temos a publicação recente de um painel detalhando as filas internas de cada unidade organizacional envolvida na avaliação de estudos necessários para o registro de medicamentos sintéticos e semissintéticos. Além disso, foi disponibilizado um relatório de gestão ao público, demonstrando a evolução das análises e dos pedidos de registros recebidos pela Agência.
Apesar disso, ainda é relevante contextualizar o aumento significativo no volume de processos priorizados, especialmente na categoria de genéricos, que tem impactado diretamente as análises de pedidos não priorizados de medicamentos genéricos e similares. Embora avanços notáveis tenham sido alcançados na regularização desses casos prioritários, o crescente volume de solicitações dessa natureza tem sobrecarregado os recursos disponíveis para a análise de outros processos. Confira abaixo dois gráficos que ajudam a visualizar a situação.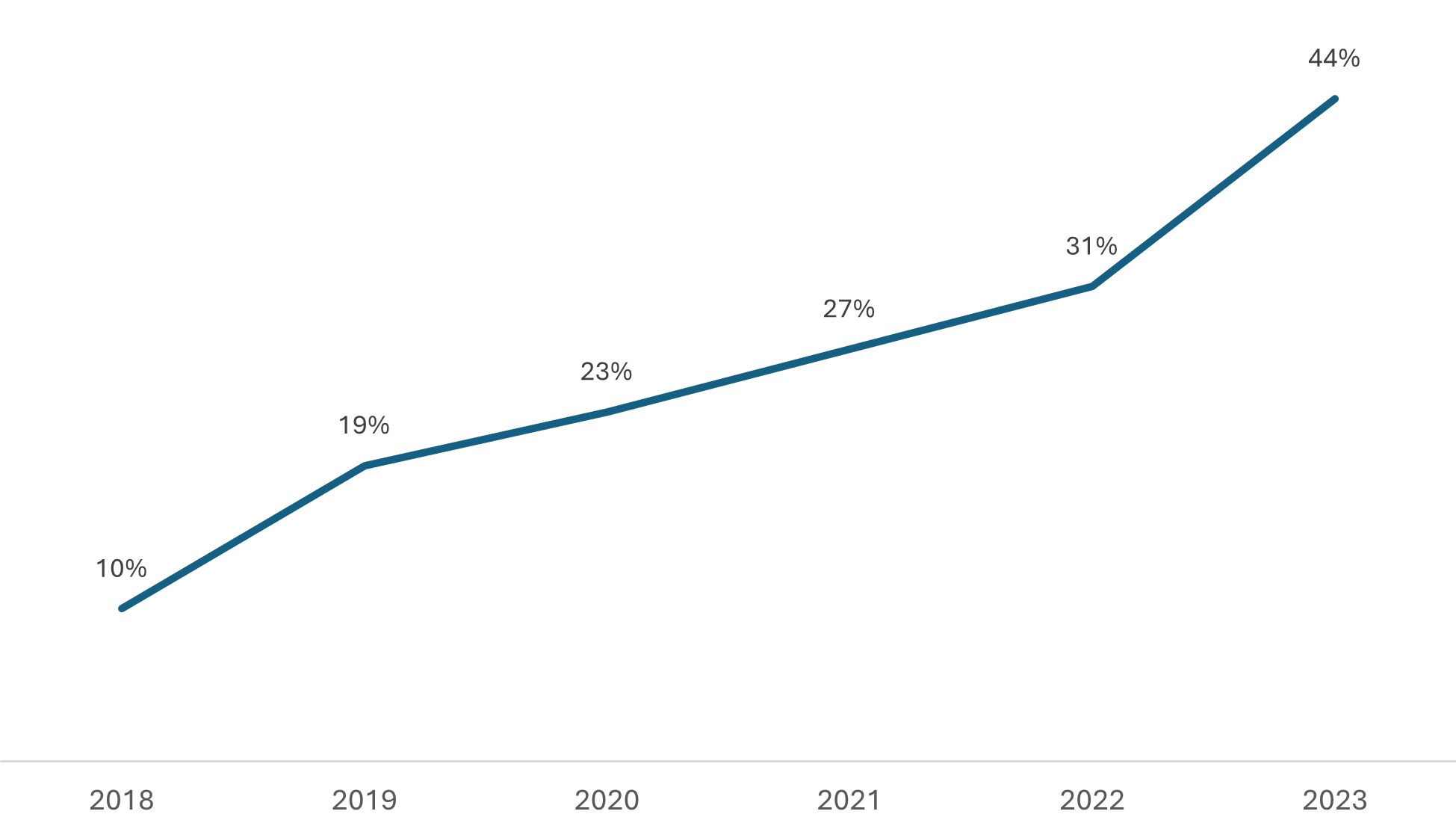 Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
O Gráfico 1 mostra a ocupação da capacidade de análise da Gerência de Qualidade em Medicamentos (GQMED) com processos de genéricos priorizados ao longo do tempo.
Observa-se a variação na carga de trabalho e como isso tem afetado a capacidade de análise da GQMED. 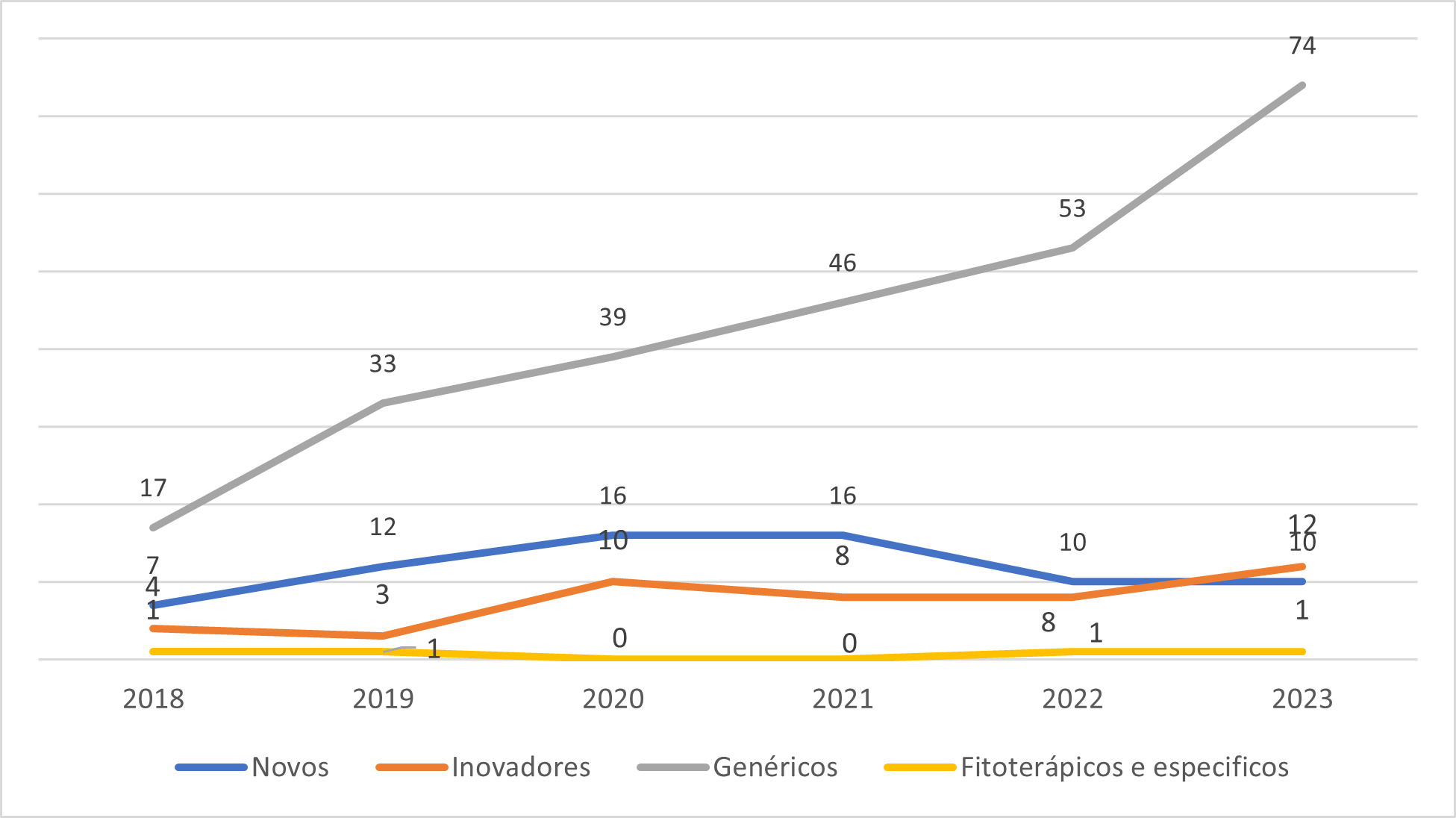 Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
O Gráfico 2 ilustra a evolução dos pedidos de priorização de todos os registros de medicamentos sintéticos e semissintéticos. Destaca-se o aumento significativo na demanda por priorização, especificamente de medicamentos genéricos, o que tem impactado diretamente a dinâmica das análises realizadas pela Anvisa. Esse incremento acentuado também foi observado no ano de 2024, no qual o volume de processos de genéricos priorizados já representa 60% do total previsto para ser analisado no primeiro trimestre.
Portanto, se não houver aumento no número de técnicos responsáveis pelas análises e se for mantido o ritmo de crescimento, que em análise inicial indica um direcionamento da indústria para esse nicho de genéricos priorizados, é esperado que a velocidade de início das análises dos pedidos de registros de medicamentos genéricos e similares não priorizados continue diminuindo.
Por fim, a Anvisa reitera seu compromisso em atuar de forma diligente e responsável na análise dos processos, sempre visando o interesse público e a segurança dos cidadãos.
Esta notícia está clara para você? Clique aqui e responda nossa pesquisa em menos de 1 minuto. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos filas de análise genéricos similares registro
Fonte: Site da ANVISA
Read More
Anvisa cria a Câmara Técnica de Registro de Medicamentos
Foi publicada nesta segunda-feira (14/8) a Portaria n. 875, de 10 de agosto de 2023, que cria a Câmara Técnica de Registro de Medicamentos, a Cateme, e nomeia os seus membros.
A Cateme tem como objetivo realizar estudos técnicos e emitir recomendações referentes ao registro de medicamentos e produtos biológicos, servindo como fonte de orientação técnica e de evidências científicas para auxiliar no processo de avaliação e tomada de decisão no âmbito do registro desses produtos e de suas pesquisas clínicas.
A Câmara também prevê grupos de trabalho que poderão ser criados posteriormente, sob a coordenação de um de seus membros, e que irão desenvolver discussões de temas mais específicos relativas ao registro de medicamentos e produtos biológicos, podendo contar com a participação de convidados.
Além disso, a Cateme amplia a participação social no processo decisório da Anvisa, possibilitando uma discussão qualificada com os segmentos da sociedade civil interessados no acesso da população a medicamentos e produtos biológicos. Ela é composta por dez membros com mandato de três anos, entre representantes dos consumidores e especialistas de universidades, institutos de pesquisa e hospitais públicos e privados, com habilidades e competências afins ao processo de regularização de medicamentos e produtos biológicos.Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos vacinas cateme câmara técnica
Fonte: Site da ANVISA
Read More
Anvisa divulga dados do anuário sobre a indústria farmacêutica no Brasil
A Secretaria-Executiva da Câmara de Regulação do Mercado de Medicamentos (SCMED) divulgou a 6ª edição do Anuário Estatístico do Mercado Farmacêutico.
A publicação reúne dois grandes grupos de informações: um dedicado ao panorama do mercado farmacêutico em 2022 e outro com séries históricas entre 2020 e 2022.
O objetivo do anuário é oferecer, de forma racional e organizada, estatísticas sobre a indústria de fármacos no Brasil. Para traçar o perfil do mercado, o levantamento considerou dados consolidados até junho de 2023, extraídos dos relatórios de comercialização encaminhados pelas empresas, sobre produtos farmacêuticos regulados pela Câmara de Regulação do Mercado de Medicamentos (CMED), divididos em seis grupos distintos de fármacos: biológicos, específicos, genéricos, similares, novos e fitoterápicos.
A publicação traz uma ampla variedade de informações sobre a evolução do mercado farmacêutico, o faturamento anual obtido, os produtos comercializados, as características dos medicamentos, os canais de distribuição, as substâncias mais comercializadas, entre outras.
Para a elaboração do documento, foram utilizadas as informações disponíveis no Sistema de Acompanhamento do Mercado de Medicamentos (Sammed).
Dados gerais
De acordo com as informações do anuário, a venda de medicamentos no Brasil gerou um faturamento de R$ 131,2 bilhões em 2022. Em termos percentuais, o faturamento do setor industrial farmacêutico brasileiro, cujo valor em 2021 era de R$ 135,2 bilhões, teve uma redução de cerca de 3%.
Quanto à quantidade de embalagens comercializadas, o setor encolheu mais de 5,8%, atingindo o volume de 5,7 bilhões de unidades em 2022, comparadas às 6 bilhões de unidades comercializadas em 2021.
O relatório revela também que, em 2022, foram identificados 4.748 produtos cadastrados e em comercialização no país. Destes, 40,9% eram medicamentos genéricos e 29,1%, similares. Portanto, similares e genéricos corresponderam a 70% do total de unidades comercializadas em 2022. Outros tipos de produtos representaram 30%.
O documento aponta que o faturamento dos medicamentos novos apresentou maior representatividade no mercado, somando mais de R$ 43,2 bilhões (33,9% do total), seguido dos medicamentos biológicos, que acumularam mais de R$ 34 bilhões (25,9% do total). Já os medicamentos similares alcançaram a terceira posição, com um faturamento de R$ 24,9 bilhões (19% do total), e os genéricos acumularam um faturamento de R$ 19,9 bilhões (15,1% do total).
Preços médios
O anuário destaca que o preço médio global de medicamentos praticado em 2022 foi de R$ 22,98 – os medicamentos biológicos atingiram, no ano passado, o valor médio de R$ 379,90, enquanto que os medicamentos novos e similares apresentaram preços médios praticados de R$ 45,62 e R$ 15,03, respectivamente. Os medicamentos genéricos tiveram preço médio de R$ 8,50, os fitoterápicos de R$ 4,81, enquanto o menor preço observado foi dos medicamentos específicos, de R$ 1,77.
Empresas, apresentações e princípios ativos
Segundo as informações do documento, o número de empresas que comercializaram medicamentos no Brasil passou de 234, em 2021, para 217, em 2022. Juntas, essas empresas venderam 13.817 apresentações de medicamentos, 1,1% a menos do que em 2021.
Com relação à quantidade de princípios ativos, matérias-primas envolvidas na produção de medicamentos, foram identificados um total de 2.001. O anuário informa também um montante de 505 classes terapêuticas comercializadas em 2022, quando em 2021 o total foi de 509. Essas classes terapêuticas são definidas conforme a ação do medicamento no organismo.
No que se refere à liderança do mercado, vale destacar que, no ranking das 20 maiores empresas independentes (não pertencentes a grupos econômicos), a Fundação Oswaldo Cruz (Fiocruz) figura em primeiro lugar entre as empresas independentes que mais faturaram em 2022 e o Instituto Butantan aparece em 7º lugar entre as 20 maiores empresas.
Série histórica
A série histórica entre 2020 e 2022 tornou possível uma melhor avaliação do comportamento desse mercado, considerando inclusive ser este o período que compreendeu a pandemia de Covid-19.
Em linhas gerais, pôde ser constatada a manutenção de um mercado vigoroso, que cresceu 20,4% em faturamento neste período, porém decresceu 25,8% no volume de embalagens comercializadas.
Confira abaixo um resumo do panorama geral do mercado farmacêutico em 2022.
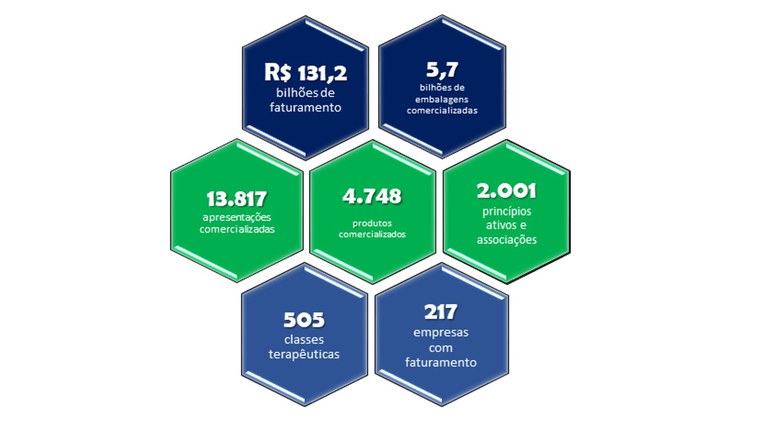
Leia a íntegra da 6ª edição do Anuário Estatístico do Mercado Farmacêutico, com dados de 2022 e séries históricas de 2020 a 2022. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos mercado farmacêutico anuário estatístico
Fonte: Site da ANVISA
Read More
Cooperação técnica: Anvisa e estado de São Paulo fazem acordo na área de farmacovigilância
O Acordo de Cooperação Técnica (ACT) na área de farmacovigilância com o Centro de Vigilância Sanitária do estado de São Paulo, vinculado à Secretaria de Estado da Saúde (SES-SP), foi assinado pela SES-SP em 4 de agosto. O extrato do acordo foi publicado no Diário Oficial da União (DOU) da última segunda-feira (7/8). A Anvisa já havia assinado o documento em 5 de maio. Faz parte do ACT um plano de trabalho, também já firmado.
Para celebrar a parceria, será realizado um evento no dia 21 de setembro, na sede da Agência, em Brasília. Posteriormente, serão divulgadas, aqui no portal, mais informações a respeito, como horários e programação completa.
Teor do acordo
Com prazo de vigência de cinco anos, o acordo prevê a utilização, pelo estado de São Paulo, do sistema VigiMed, destinado à notificação de eventos adversos relacionados a medicamentos. O acordo inclui ainda a realização de treinamentos da equipe da Vigilância Sanitária e de notificadores de São Paulo, além da elaboração de materiais educativos e da revisão do marco normativo estadual. Vale observar que o sistema estadual, o Periweb, será desativado.
Avanços
A medida contribuirá para o desenvolvimento do Sistema Nacional de Farmacovigilância (SNFV), no âmbito do Sistema Nacional de Vigilância Sanitária (SNVS). Além disso, deverá fortalecer a farmacovigilância no próprio estado, uma vez que imprime mais robustez à rede de dados para detecção de sinais de segurança de medicamentos.
É importante lembrar que São Paulo conta com o maior parque nacional de indústrias farmacêuticas e a maior concentração de serviços de saúde, inclusive os de alta complexidade. Ademais, o estado detém a maior população dentre as unidades federativas e abriga uma rede de universidades e centros de pesquisa de ponta, ou seja, ele reúne um conjunto de condições favoráveis à farmacovigilância, à identificação de eventos adversos e à geração de conhecimento.
VigiMed: saiba mais
O VigiMed é o sistema nacional para notificação de eventos adversos a medicamentos no Brasil. Ele é mantido pelo Uppsala Monitoring Centre (UMC), um centro colaborador da Organização Mundial da Saúde (OMS) na área de monitoramento global de medicamentos. O sistema utiliza dicionários padronizados para eventos adversos (MedDra) e medicamentos (WhoDrug), o que facilita a organização e a comparação de dados. Categoria
Saúde e Vigilância Sanitária
Tags: farmacovigilância vigimed acordo de cooperação técnica eventos adversos medicamentos
Fonte: Site da ANVISA
Read More
