
Esclarecimentos sobre a transparência das filas de análise na Anvisa
Aumento no volume de processos priorizados tem impactado as filas.
Recentemente, a área de Medicamentos da Anvisa recebeu alguns questionamentos sobre o ritmo das filas de análise de medicamentos genéricos e similares. Em resposta, a Agência reitera seu compromisso primordial de garantir a segurança, a eficácia e a qualidade dos produtos submetidos à sua análise.
Destaca-se o contínuo esforço para aprimorar os sistemas e procedimentos da Anvisa, visando mais eficiência e transparência em suas atividades. Como exemplo, temos a publicação recente de um painel detalhando as filas internas de cada unidade organizacional envolvida na avaliação de estudos necessários para o registro de medicamentos sintéticos e semissintéticos. Além disso, foi disponibilizado um relatório de gestão ao público, demonstrando a evolução das análises e dos pedidos de registros recebidos pela Agência.
Apesar disso, ainda é relevante contextualizar o aumento significativo no volume de processos priorizados, especialmente na categoria de genéricos, que tem impactado diretamente as análises de pedidos não priorizados de medicamentos genéricos e similares. Embora avanços notáveis tenham sido alcançados na regularização desses casos prioritários, o crescente volume de solicitações dessa natureza tem sobrecarregado os recursos disponíveis para a análise de outros processos. Confira abaixo dois gráficos que ajudam a visualizar a situação.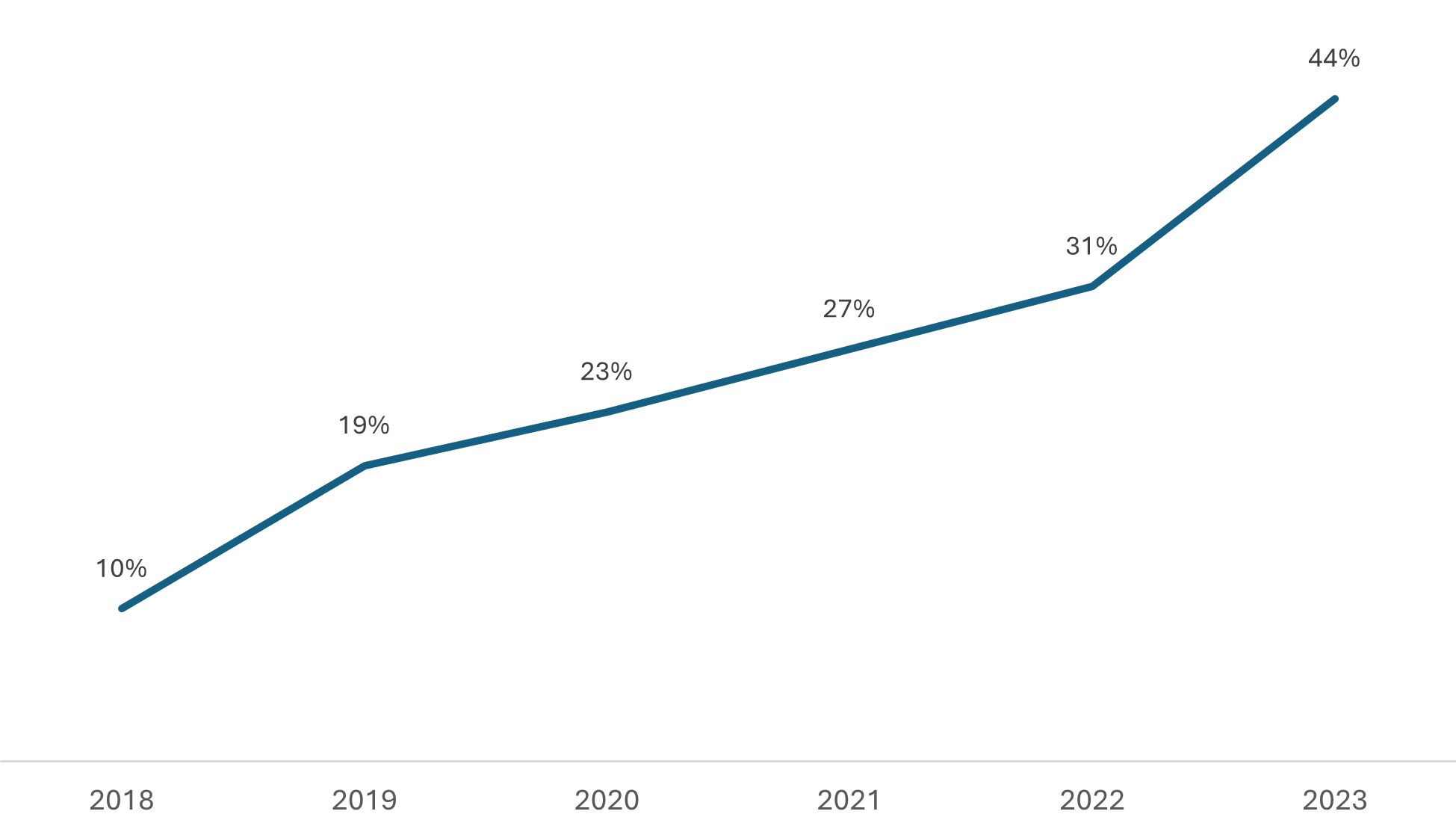 Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
O Gráfico 1 mostra a ocupação da capacidade de análise da Gerência de Qualidade em Medicamentos (GQMED) com processos de genéricos priorizados ao longo do tempo.
Observa-se a variação na carga de trabalho e como isso tem afetado a capacidade de análise da GQMED. 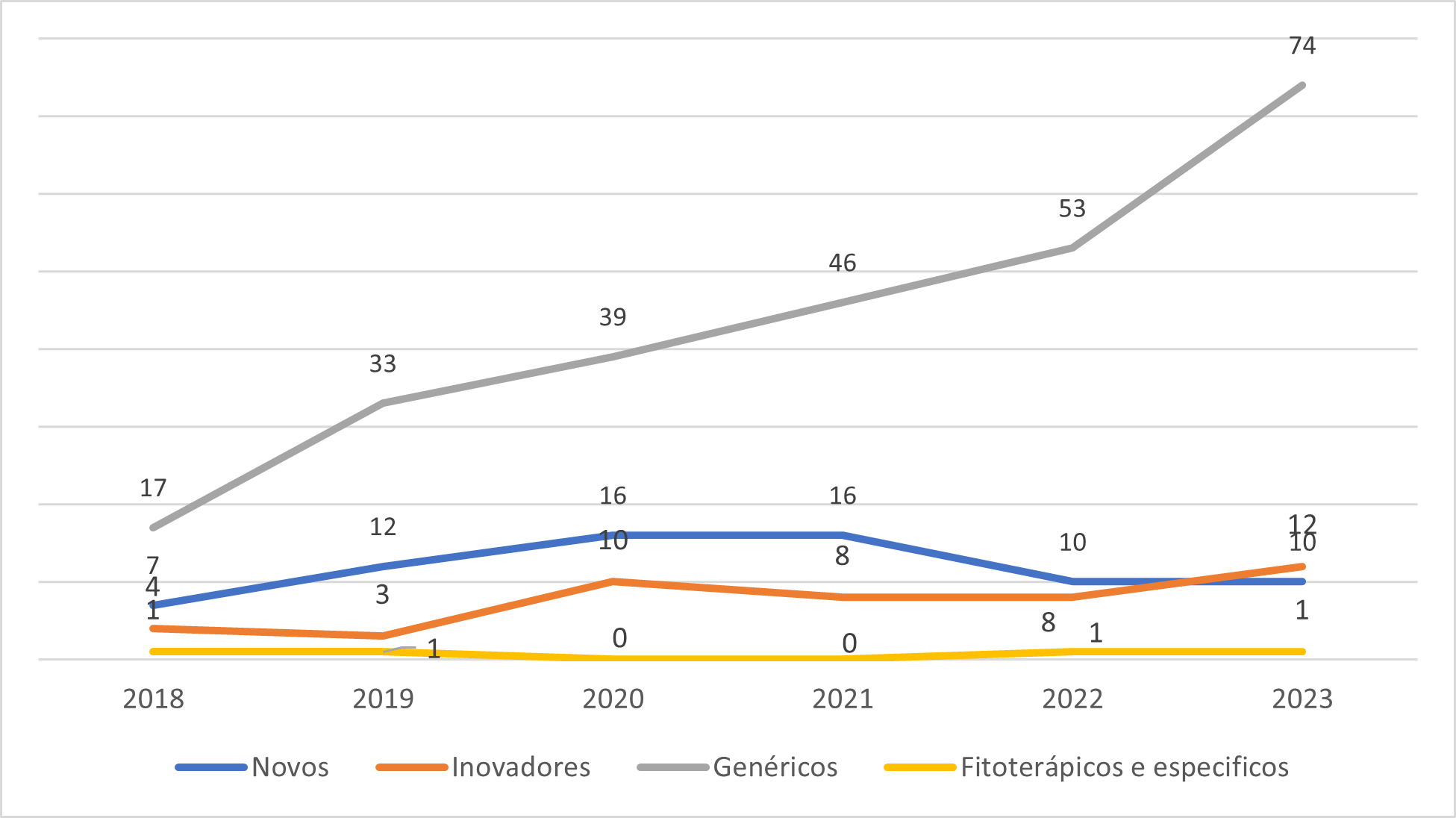 Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
O Gráfico 2 ilustra a evolução dos pedidos de priorização de todos os registros de medicamentos sintéticos e semissintéticos. Destaca-se o aumento significativo na demanda por priorização, especificamente de medicamentos genéricos, o que tem impactado diretamente a dinâmica das análises realizadas pela Anvisa. Esse incremento acentuado também foi observado no ano de 2024, no qual o volume de processos de genéricos priorizados já representa 60% do total previsto para ser analisado no primeiro trimestre.
Portanto, se não houver aumento no número de técnicos responsáveis pelas análises e se for mantido o ritmo de crescimento, que em análise inicial indica um direcionamento da indústria para esse nicho de genéricos priorizados, é esperado que a velocidade de início das análises dos pedidos de registros de medicamentos genéricos e similares não priorizados continue diminuindo.
Por fim, a Anvisa reitera seu compromisso em atuar de forma diligente e responsável na análise dos processos, sempre visando o interesse público e a segurança dos cidadãos.
Esta notícia está clara para você? Clique aqui e responda nossa pesquisa em menos de 1 minuto. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos filas de análise genéricos similares registro
Fonte: Site da ANVISA
Read More
Disponível plataforma de interesse de registro
Empresas que detém petição de registro de medicamentos genéricos e similares na Anvisa já podem informar o interesse em manter ou desistir do processo. A Agência disponibilizou uma Plataforma Eletrônica para inserção destas informações. Acesse a plataforma aqui.
A criação desta plataforma estava prevista no Edital de Chamamento nº 11/2017, publicado no dia 31 de agosto no Diário Oficial da União (DOU). O regulamento, que estabelece regras para que as empresas manifestem o interesse no processo ou desistência, a chamada Manifestação de Desistência, estabeleceu um prazo de 15 dias para que a Anvisa criasse o sistema. Os detalhes do regulamento estão descritos no Anexo I do Edital.
As empresas abrangidas pelo texto são aquelas que estão na fila de registro de genéricos e similares do Grupo 4. As petições da fila de análise de registro medicamentos genéricos e similares estão estruturadas em quatro grupos, considerando as formas farmacêuticas, os Insumos Farmacêuticos Ativos (IFA), o volume de petições por empresa e a ordem cronológica, da seguinte forma:
Grupo 1 (G1) – processos que entraram na Anvisa depois de 29.03.2017;
Grupo 2 (G2) – processos de 7 formas farmacêuticas agrupadas por semelhança e processos produtivos controlados;
Grupo 3 (G3) – processos de empresas com 1 ou 2 petições; e
Grupo 4 (G4) – demais processos de genéricos e similares.
Para atender ao passivo de registros, conforme disposto no artigo 4° da Lei 13.411/2016, a Anvisa estabeleceu estratégia para avaliação dos processos de registro de medicamentos genéricos e similares protocolados e ainda não avaliados.
A avaliação de processos que as empresas não têm interesse consome valiosos recursos da Agência, em especial humanos, que poderiam ser direcionados para processos de real importância para a empresa.
Acesse a Plataforma Eletrônica de Manifestação de Interesse.
Fonte: Site da ANVISA
Read More
Esclarecimentos sobre peticionamentos realizados na vigência exclusiva da RDC 73/2016
Com a revogação da RDC nº 48/2009, em 31/01/2017, e vigência exclusiva da RDC nº 73/2016, as petições de pós-registro de medicamentos genéricos, novos e similares peticionadas a partir de 01/02/2017 devem seguir exclusivamente os termos da nova resolução.
Para isso foram disponibilizados, desde novembro de 2016, novos assuntos de petição relativos à RDC 73/2016, por meio dos quais devem, exclusivamente, ser realizados os protocolos que ocorrerem a partir de fevereiro de 2017. Alguns assuntos de petição, como de cancelamentos e alteração de nome comercial, permanecerão os mesmos.
Os assuntos podem ser consultados na sua íntegra por meio do Sistema de Consulta de Assuntos de Petição.
As petições protocoladas após 01/02/2017 pelos assuntos de petição de pós-registro definidos na RDC nº 48/2009 e na IN nº 11/2009 com provas referentes a essas normas serão objeto de indeferimento.
Para petições protocoladas após 01/02/2017 pelos assuntos de petição de pós-registro definidos na RDC nº 48/2009 e na IN nº 11/2009 com provas referentes à RDC nº 73/2016 a empresa deverá solicitar a troca do assunto via e-mail gepre@anvisa.gov.br, informando número do expediente e código de assunto em conformidade com a RDC nº 73/2016.
Para os demais casos, em que a empresa tiver efetuado pagamento de transações referente às petições manuais seguindo os assuntos de petição estabelecidos na RDC nº 48/2009 e IN nº 11/2009, mas ainda não houve o protocolo, deve incluir no campo observações da folha de rosto da petição o seguinte dizer: “Conforme orientação disponível no portal da Anvisa o assunto correto a ser cadastrado em conformidade com a RDC nº 73/2016 é: código de assunto – descrição do assunto”. Aconselha-se também o envio do e-mail para gepre@anvisa.gov.br, informando número do expediente e código de assunto em conformidade com a RDC nº 73/2016.
Caso haja diferença – a menor – entre valor da taxa recolhida originalmente e valor da taxa para o novo assunto, conforme porte econômico na data de PROTOCOLO da GRU, a TFVS deverá ser complementada.
Fonte: Site da ANVISA
Read More
